ZOLADEX® 3,6 mg e ZOLADEX® LA 10,8 mg
acetato de gosserrelina
Atenção: seringa com novo sistema de proteção da agulha
3,6 mg e 10,8 mg
FORMAS FARMACÊUTICAS E APRESENTAÇÔES - ZOLADEX
Depot e depot de liberação prolongada. Embalagem com uma seringa para injeção subcutânea abdominal previamente carregada com um depot cilíndrico estéril, de coloração cremosa, no qual o acetato de gosserrelina é disperso em uma matriz biodegradável.
USO ADULTO
- COMPOSIÇÃO
Cada depot contém:
acetato de gosserrelina.........................3,6 mg
Excipiente: lactato-glicolato.
Cada depot de liberação prolongada contém:
acetato de gosserrelina.........................10,8 mg
Excipiente: lactato-glicolato.
INFORMAÇÕES AO PACIENTE - ZOLADEX
Ação esperada do medicamento: a melhora dos sintomas é observada no decorrer do tratamento.
Cuidados de armazenamento: conservar em temperatura inferior a 25°C. Não congelar. O conteúdo da embalagem é estéril até sua abertura. Portanto, não utilize o produto caso sua embalagem interna esteja aberta.
Prazo de validade: vide cartucho. Não use medicamento com prazo de validade vencido.
Gravidez e lactação: informe seu médico a ocorrência de gravidez na vigência do tratamento ou após seu término. Informe ao médico se está amamentando. ZOLADEX não deve ser utilizado por mulheres grávidas ou que estejam amamentando.
Cuidados de administração: siga a orientação do seu médico, respeitando sempre os horários, a dose e a duração do tratamento. Mulheres que fazem uso de ZOLADEX não devem tomar anticoncepcionais injetáveis nem pílulas. Durante o tratamento deve ser utilizado um método anticoncepcional não-hormonal. Seu médico irá orientá-la a este respeito.
Interrupção do tratamento: não interromper o tratamento sem o conhecimento do seu médico.
Reações adversas: durante o tratamento com ZOLADEX podem ocorrer ondas de calor, dificuldade para urinar, dor nos ossos e, às vezes, reações na pele. Informe seu médico o aparecimento de reações desagradáveis.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
Ingestão concomitante com outras substâncias: enquanto estiver em tratamento com ZOLADEX não tome nenhum outro medicamento sem o consentimento de seu médico.
Contra-indicações e precauções: ZOLADEX é contra-indicado para mulheres grávidas ou amamentando e não deve ser administrado a pacientes com hipersensibilidade ao produto ou a outros agonistas do LHRH. Após a 2 aplicação de ZOLADEX, não mexa no local até sua próxima visita ao médico. Informe seu médico sobre qualquer medicamento que esteja usando, antes do início ou durante o tratamento.
Efeitos sobre a capacidade de dirigir autos e operar máquinas: não há evidência de que a administração deZOLADEX resulte em comprometimento da habilidade de dirigir autos ou operar máquinas.
NÃO TOME REMÉDIO SEM O CONHECIMENTO DO SEU MÉDICO. PODE SER PERIGOSO PARA SUA SAÚDE.
CARACTERÍSTICAS - ZOLADEX
Propriedades Farmacodinâmicas
ZOLADEX é um análogo sintético do hormônio de liberação do hormônio luteinizante (LHRH) que ocorre naturalmente. A administração crônica de ZOLADEX resulta na inibição da secreção de hormônio luteinizante (LH) pela pituitária, o que leva a uma queda nas concentrações séricas de testosterona nos homens e de estradiol nas mulheres.
Assim como outros agonistas do LHRH, ZOLADEX inicialmente pode aumentar, de forma transitória, as concentrações séricas de testosterona no homem e de estradiol nas mulheres.
Em homens, por volta do 21o dia após a primeira injeção do depot, as concentrações de testosterona caem para uma faixa de castração e assim permanecem com o tratamento contínuo a cada 28 dias e 12 semanas, com as dosagens de 3,6 mg e 10,8 mg, respectivamente. Esta inibição leva a regressão do tumor da próstata e a melhora sintomática na maioria dos pacientes.
Se em circunstâncias excepcionais a administração não for repetida após 3 meses quando do uso de ZOLADEXLA 10,8 mg, os dados indicam que os níveis de testosterona de castração são mantidos por até 16 semanas na maioria dos pacientes.
Em mulheres, as concentrações séricas de estradiol são suprimidas por volta do 21o dia após a primeira injeçãodo depot de 3,6 mg e, com o tratamento contínuo a cada 28 dias, permanecem suprimidas a níveis comparáveis àqueles observados em mulheres na pós-menopausa. Essa supressão está associada com diminuição da espessura do endométrio, a supressão do desenvolvimento folicular dentro do ovário, e uma resposta do câncerde mama hormônio-dependente (tumores que são RE positivos e/ou RPg positivos), endometriose e leiomiomauterino e irá resultar em amenorréia na maioria das pacientes.
Em mulheres, as concentrações séricas de estradiol são suprimidas ao redor de 4 semanas após a primeirainjeção do depot de 10,8 mg e, permanecem assim até o final do período de tratamento. Em pacientes com estradiol já suprimido por um análogo do LHRH, a supressão é mantida com a mudança da terapia paraZOLADEX LA 10,8 mg. A supressão do estradiol está associada com uma resposta da endometriose e dos leiomiomas uterinos, resultando em amenorréia na maioria das pacientes.
O tratamento com análogos do LHRH pode causar a ocorrência de menopausa natural. Raramente, algumas mulheres não retornam a menstruar após o término da terapia.
No início do tratamento com ZOLADEX, algumas mulheres podem apresentar sangramento vaginal de duração e intensidade variáveis. Tal sangramento representa, provavelmente, supressão do estrógeno e espera-se que pare espontaneamente.
Propriedades Farmacocinéticas
A biodisponibilidade de ZOLADEX é quase que completa. Sua administração a cada 4 e 12 semanas na dosagem de 3,6 mg e 10,8 mg, respectivamente, assegura a manutenção de concentrações eficazes, sem acúmulo nos tecidos.
ZOLADEX apresenta pouca ligação às proteínas plasmáticas e possui uma meia-vida de eliminação sérica de duas a quatro horas em pacientes com função renal normal, a qual é aumentada na presença de função renalcomprometida. Para o composto administrado mensalmente ou trimestralmente na formulação em depot 3,6 mg ou 10,8 mg, respectivamente, esta alteração apresentará um efeito mínimo. Por esta razão, não é necessária nenhuma modificação de dose para esses pacientes. Não há alteração significante da farmacocinética em pacientes com insuficiência hepática.
- INDICAÇÕES
ZOLADEX 3,6 mg é indicado para:
- Controle de câncer prostático passível de manipulação hormonal.
- Controle de câncer de mama passível de manipulação hormonal, em mulheres em pré e perimenopausa.
- Controle da endometriose, aliviando os sintomas, inclusive a dor, e reduzindo o tamanho e o número daslesões endometriais.
- Controle de leiomioma uterino, reduzindo o seu volume na maioria dos casos, melhorando o estado hematológico da paciente e reduzindo os sintomas, inclusive a dor. É utilizado previamente à cirurgia para facilitar as técnicas operatórias e reduzir a perda sangüínea intra-operatória.
- Diminuição da espessura do endométrio, utilizado antes da ablação endometrial.
- Fertilização assistida: bloqueio hipofisário na preparação para a superovulação.
ZOLADEX LA 10,8 mg é indicado para:
- Controle de câncer prostático passível de manipulação hormonal.
- Controle da endometriose, aliviando os sintomas, inclusive a dor, e reduzindo o tamanho e o número daslesões endometriais.
- Controle de leiomioma uterino, reduzindo o seu volume na maioria dos casos, melhorando o estado hematológico da paciente e reduzindo os sintomas, inclusive a dor. É utilizado previamente à cirurgia para facilitar as técnicas operatórias e reduzir a perda sangüínea intra-operatória.
- CONTRA-INDICAÇÕES
É contra-indicado para pacientes com hipersensibilidade grave conhecida à gosserrelina ou a qualquer componente do produto, grávidas e lactantes.
PRECAUÇÕES E ADVERTÊNCIAS - ZOLADEX
O tratamento deve ser realizado sob a supervisão de médico experiente em quimioterapia antineoplásica.
Inicialmente o acetato de gosserrelina, como outros agonistas do LHRH acarreta aumento temporário dos níveis séricos de testosterona. Podem ocorrer piora temporária dos sintomas ou ocorrência adicional de sinais esintomas de câncer prostático durante as primeiras semanas de tratamento.
Como outros agonistas do LHRH, casos isolados de obstrução ureteral e compressão da medula espinhal têm sido observados. Caso isto ocorra, o tratamento padrão deve ser instituído e, em casos extremos, deve-se considerar uma orquiectomia.
Após tratamento repetido a longo prazo com ZOLADEX, observou-se um aumento na incidência de tumores benignos da pituitária em ratos machos. Embora esta descoberta seja semelhante ao que se observou anteriormente nesta espécie após castração cirúrgica, não se estabeleceu qualquer relevância da mesma em relação ao homem.
Em camundongos, a administração a longo prazo de múltiplos das doses para seres humanos produziu alterações histológicas em algumas regiões do sistema digestivo. Estas se manifestaram por hiperplasia celular das ilhotas pancreáticas e uma proliferação celular benigna na região pilórica do estômago, também relatadas como lesões espontâneas nessa espécie. A relevância clínica desses achados não está esclarecida.
O uso de ZOLADEX em homens com risco específico de desenvolver obstrução ureteral ou compressão da medula espinhal deve ser cuidadosamente avaliado, e os pacientes devem ser acompanhados de perto durante o primeiro mês de tratamento. Se a compressão de medula espinhal ou comprometimento renal devido à obstrução ureteral estiverem presentes, ou existir a possibilidade de sua ocorrência, deve-se instituir tratamento específico para essas complicações.
Deve-se levar em consideração a relação risco/benefício quando existem os seguintes problemas médicos: metástases vertebrais, sensibilidade ao fármaco e uropatia obstrutiva.
Pacientes do sexo feminino que estejam fazendo uso de ZOLADEX devem adotar métodos anticoncepcionais não-hormonais durante o tratamento.
O uso de agonistas do LHRH em mulheres pode causar uma diminuição da densidade mineral óssea. Dados preliminares sugerem que o uso de ZOLADEX 3,6 mg em combinação com tamoxifeno para pacientes com câncerde mama, pode reduzir perda mineral óssea. Embora não existam dados específicos com o uso de ZOLADEX LA 10,8 mg, os dados de estudos com ZOLADEX 3,6 mg sugerem que pode haver alguma recuperação da mineralização óssea após a interrupção da terapia. Em pacientes recebendo ZOLADEX 3,6 mg para o tratamento de endometriose, a adição de terapia de reposição hormonal (um agente estrogênico diariamente e um agente progestagênico) reduziu a perda da densidade mineral óssea e os sintomas vasomotores. Não há experiência sobre o uso de terapia de reposição hormonal em mulheres recebendo ZOLADEX LA 10,8 mg.
Uma redução na tolerância à glicose foi observada em homens recebendo agonistas do LHRH. Isso pode manifestar diabetes ou perda do controle glicêmico em casos de diabetes mellitus pré-existente. Portanto, deve-se monitorar a glicose sanguinea.
Dados preliminares sugerem que o uso de bifosfonados em combinação com agonistas do LHRH podem reduzir a perda mineral óssea em homens.
Após a interrupção da terapia com ZOLADEX LA 10,8 mg, o tempo para o retorno da menstruação pode ser prolongado em algumas pacientes.
O uso de ZOLADEX pode causar aumento da resistência cervical e cautela deve ser tomada ao dilatar a cérvix.
Até o momento não há dados clínicos sobre a eficácia do tratamento de afecções ginecológicas benignas comZOLADEX por períodos superiores a seis meses.
Uso pediátrico
ZOLADEX não é indicado para crianças, pois a segurança e a eficácia da gosserrelina não foram estabelecidas neste grupo de pacientes.
Reprodução assistida
ZOLADEX 3,6 mg deve ser apenas administrado como parte de um regime para a reprodução assistida, sob supervisão de um especialista experiente da área. Assim como para outros agonistas do LHRH, existem alguns relatos de síndrome de hiperestimulação ovariana (SHO) associada ao uso de ZOLADEX 3,6 mg em combinação com gonadotrofinas. O ciclo de estimulação deve ser cuidadosamente monitorado para identificar pacientes com risco de desenvolver essa síndrome. A gonadotrofina humana (hCG) deve ser bloqueada, se apropriado.
Recomenda-se cautela ao usar ZOLADEX 3,6 mg em regimes de reprodução assistida em pacientes comsíndrome do ovário policístico, pois pode haver aumento do recrutamento de folículos.
Uso durante a gravidez e lactação
ZOLADEX não deve ser utilizado durante a gravidez, pois há um risco teórico de aborto ou anormalidade fetal se forem utilizados agonistas do LHRH na gravidez. Mulheres potencialmente férteis devem ser cuidadosamente examinadas antes do início do tratamento para excluir uma possível gravidez. Devem ser utilizados métodos anticoncepcionais não hormonais durante o tratamento. Somente após o retorno da menstruação poderão ser utilizados métodos contraceptivos hormonais.
A gravidez deve ser excluída antes que ZOLADEX 3,6 mg seja utilizado para fertilização assistida. Quando empregado com esse fim, não há evidência clínica que sugira uma associação causal entre ZOLADEX 3,6 mg e qualquer anormalidade subseqüente de desenvolvimento de oócito ou gravidez e parto.
O uso de ZOLADEX durante o período de amamentação é contra-indicado.
Testes Laboratoriais
A administração de ZOLADEX em doses terapêuticas resulta na supressão do sistema pituitário-gonadal. Os testes diagnósticos das funções pituitárias gonadotrópica e gonadal realizados durante o tratamento comZOLADEX e até que o fluxo menstrual seja retomado podem apresentar resultados alterados devido a seu efeito supressor. Geralmente a função normal é restaurada dentro de 12 semanas após a interrupção do tratamento.
- INTERAÇÕES MEDICAMENTOSAS
Não são conhecidas até o momento.
REAÇÕES ADVERSAS - ZOLADEX
As seguintes categorias de frequência de reações adversas medicamentosas foram calculadas com base em relatórios de ensaios clínicos e fontes pós-comercialização de ZOLADEX 3,6 mg e 10,8 mg.
Tabela 1 - Reações adversas medicamentosas por frequência e Classe de Sistema de órgãos (CSO)
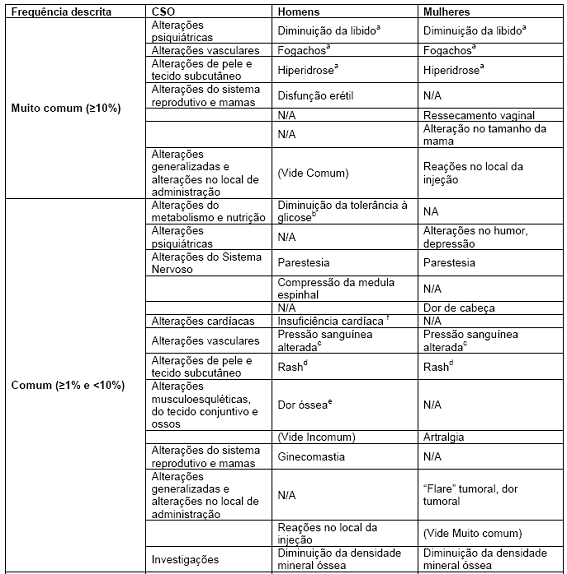


a Estes são os efeitos farmacológicos que raramente exigem a interrupção do tratamento.
b A redução da tolerância à glicose foi observada em homens que receberam os agonistas LHRH. Isso pode se manifestar como diabetes ou a perda do controle da glicemia nos pacientes com diabetes mellitus pré-existente.
c Estes podem manifestar-se como hipotensão ou hipertensão, foram ocasionalmente observadas em pacientes cujo ZOLADEX foi administrado. As alterações são geralmente transitórias, sendo sanadas durante a continuação do tratamento ou após o término da terapia com ZOLADEX. Raramente, tais alterações foram suficientes para exigir intervenção médica, incluindo a retirada do tratamento de ZOLADEX.
d Estes são geralmente leves, muitas vezes regredindo sem interrupção do tratamento.
e Inicialmente, pacientes com câncer de próstata podem enfrentar um aumento temporário de dor óssea, que podem ser tratados sintomaticamente.
f Observado em um estudo fármaco-epidemiológico do uso de agonistas LHRH no tratamento do câncer depróstata. O risco parece ser maior quando usado em combinação com anti-andrógenos.
- POSOLOGIA E MODO DE USAR
Adultos: um depot de ZOLADEX de 3,6 mg, injetado por via subcutânea na parede abdominal inferior a cada 28 dias nos casos de:
- Controle de câncer prostático passível de manipulação hormonal.
- Controle de câncer de mama passível de manipulação hormonal, em mulheres em pré e perimenopausa.
- Controle da endometriose, aliviando os sintomas, inclusive a dor, e reduzindo o tamanho e o número daslesões endometriais.
- Controle de leiomioma uterino, reduzindo o seu volume na maioria dos casos, melhorando o estado hematológico da paciente e reduzindo os sintomas, inclusive a dor. É utilizado previamente à cirurgia para facilitar as técnicas operatórias e reduzir a perda sangüínea intra-operatória.
- Diminuição da espessura do endométrio: para diminuição da espessura do endométrio antes da ablaçãoendometrial devem ser administrados dois depots de ZOLADEX 3,6 mg, com uma diferença de quatro semanas entre um e outro, com cirurgia planejada entre zero e duas semanas após a administração do segundo depot.
- Fertilização assistida: uma vez atingido o bloqueio hipofisário com ZOLADEX 3,6 mg, a superovulação e a captação de oócito devem ser realizadas de acordo com as práticas normais.
Adultos: um depot de ZOLADEX de 10,8 mg, injetado por via subcutânea na parede abdominal inferior a cada 12 semanas nos casos de:
- Controle de câncer prostático passível de manipulação hormonal.
- Controle da endometriose, aliviando os sintomas, inclusive a dor, e reduzindo o tamanho e o número daslesões endometriais.
- Controle de leiomioma uterino, reduzindo o seu volume na maioria dos casos, melhorando o estado hematológico da paciente e reduzindo os sintomas, inclusive a dor. É utilizado previamente à cirurgia para facilitar as técnicas operatórias e reduzir a perda sangüínea intra-operatória.
Idosos: não é necessário o ajuste da dose para pacientes idosos.
Insuficiência renal: não é necessário o ajuste da dose para pacientes com insuficiência renal.
Insuficiência hepática: não é necessário o ajuste da dose para pacientes com insuficiência hepática.
Crianças: não é recomendado o uso de ZOLADEX em crianças.
- TÉCNICAS DE ADMINISTRAÇÃO
O método adequado para a administração de ZOLADEX está descrito nas instruções abaixo:
- Verifique se não há danos na embalagem antes de sua abertura. Se a embalagem estiver danificada, a seringanão deverá ser utilizada. Não remova a seringa estéril da embalagem até imediatamente antes de seu uso. Verifique se não há danos na seringa e constate se o depot de ZOLADEX está dentro da seringa.
- Coloque o paciente em uma posição confortável, com a parte inferior do corpo discretamente levantada.
- Limpe com algodão uma área na parede abdominal inferior abaixo do umbigo.
- Examine o invólucro aluminizado do produto e a seringa para verificar se existem danos.
- Remova a seringa e verifique que pelo menos parte do depósito de ZOLADEX esteja visível. Como ZOLADEXnão é uma injeção líquida, não tente remover bolhas de ar, uma vez que isto pode deslocar o depósito do medicamento.
- Retire a aba de proteção plástica da seringa e descarte-a. Remova a cobertura da agulha.
- Segure a seringa em volta do tubo. Pince com os dedos a pele do abdômen e insira a agulha formando um ângulo de 30 a 45 graus em relação à pele, com a abertura da agulha voltada para cima.
- Continue a inserir no tecido subcutâneo até que a capa protetora toque a pele do paciente.
- Para administrar o depot de ZOLADEX, pressione o êmbolo até um ponto em que não mais consiga fazê-lo. Isso vai ativar a capa protetora. Você pode ouvir um “clique” e sentirá que a capa protetora, automaticamente, começará a deslizar para cobrir a agulha.
- Se o êmbolo não for TOTALMENTE pressionado, a capa protetora NÃO será ativada.
- Retire a agulha e deixe que a capa protetora deslize e recubra a agulha.
- Descarte a seringa em um coletor de agulhas apropriado.
- Faça um curativo leve apenas para proteção.
Nota: A seringa de ZOLADEX não pode ser usada para aspiração. Se a agulha hipodérmica penetrar em um vaso sangüíneo de grande calibre, o sangue será visto instantaneamente no centro da seringa. Se um vaso for penetrado, remova a agulha do local de aplicação e inutilize a agulha e a seringa. Injete um novo produto em um outro local ainda na região abdominal.
Na improvável necessidade de remoção cirúrgica de ZOLADEX , este poderá ser localizado por ultrassom.
Atenção: no interior do invólucro há um disco contendo sílica gel para absorver a umidade. PERIGO. NÃO COMER.
- SUPERDOSAGEM
Há experiência limitada com superdosagem em humanos. Nos casos em que ZOLADEX foi administrado em intervalo menor que o indicado ou administrado em altas doses, nenhum efeito adverso clinicamente relevante tem sido observado. Os testes em animais sugerem que nenhum outro efeito, senão os terapêuticos pretendidos sobre as concentrações de hormônios sexuais e o sistema reprodutor, serão evidentes com doses mais altas deZOLADEX . Se ocorrer uma superdose, deve ser feito o controle dos sintomas.
PACIENTES IDOSOS - ZOLADEX
Vide Posologia.
PRODUTO NOVO: ESTE É UM NOVO MEDICAMENTO E, EMBORA AS PESQUISAS REALIZADAS TENHAM INDICADO EFICÁCIA E SEGURANÇA QUANDO CORRETAMENTE INDICADO E UTILIZADO, PODEM OCORRER REAÇÕES ADVERSAS IMPREVISÍVEIS AINDA NÃO DESCRITAS OU CONHECIDAS. EM CASO DE SUSPEITA DE REAÇÃO ADVERSA, O MÉDICO RESPONSÁVEL DEVE SER NOTIFICADO.
MS - 1.1618.0043
Farm. Resp.: Dra. Daniela M. Castanho - CRF-SP nº 19.097
Fabricado por: AstraZeneca UK Limited - Macclesfield
Cheshire - Reino Unido - ZOLADEX
Importado e embalado por: AstraZeneca do Brasil Ltda.
Rod. Raposo Tavares, km 26,9 - Cotia - SP - CEP 06707-000
CNPJ 60.318.797/0001-00
Indústria Brasileira
VENDA SOB PRESCRIÇÃO MÉDICA
Nº do lote, data de fabricação e data de validade: vide cartucho.
Todas as marcas nesta embalagem são propriedade do grupo de empresas AstraZeneca.
ZOL+ZOL_LA002
Logo do Sac: 0800-145578
ZOLADEX 3,6 mg e ZOLADEX LA 10,8 mg - Laboratório
AstraZeneca
Rod. Raposo Tavares, km 26,9
Cotia/SP - CEP: 06707-000
Tel: 0800 014 55 78
Fax: (11) 3737 1200
Site: http://www.astrazeneca.com.br/
